╚▄ĮŌČ╚┘|(zh©¼)┴┐ĘųöĄ(sh©┤)╬’┘|(zh©¼)Ą─┴┐ØŌČ╚Ą─ėŗ╦Ń║═ōQ╦Ń
ĪĪĪĪę╗�Īóų¬ūRĖ┼ę¬
ĪĪĪ�����ĪŻ©ę╗Ż®ėąĻP(gu©Īn)╚▄ĮŌČ╚Ą─ėŗ╦Ń
ĪĪĪĪį┌ę╗Č©£žČ╚Ž┬Ą─’¢║═╚▄ę║ųą����Ż¼╚▄┘|(zh©¼)�����Īó╚▄ä®�����Īó╚▄ę║ķgėąę╗Č©┴┐Ą─ĻP(gu©Īn)ŽĄ����ĪŻė╔┤╦┐╔▀MąąęįŽ┬ėŗ╦ŃŻ║
ĪĪĪ�ĪŻ©1Ż®Ė∙ō■(j©┤)’¢║═╚▄ę║╚▄┘|(zh©¼)�Īó╚▄䮥─┴┐═Ų╦Ń╚▄ĮŌČ╚�����Ż╗Ż©2Ż®Ė∙ō■(j©┤)╚▄ĮŌČ╚Ū¾╦Ń’¢║═╚▄ę║╦∙║¼Ą─╚▄ä®║═╚▄┘|(zh©¼)┴┐Ż╗Ż©3Ż®Ė∙ō■(j©┤)╚▄ĮŌČ╚Ū¾╦Ń’¢║═╚▄ę║į┌š¶░l(f©Ī)Ą¶ę╗Č©┴┐╚▄ä®║¾╬÷│÷Ą─ĮY(ji©”)Š¦┴┐���Ż╗Ż©4Ż®ė╔ė┌╬’┘|(zh©¼)į┌▓╗═¼£žČ╚Ž┬╚▄ĮŌČ╚▓╗═¼Ż¼┐╔ęįĖ∙ō■(j©┤)▓╗═¼£žČ╚Ž┬Ą─╚▄ĮŌČ╚Ū¾╦Ń│÷ę╗Č©┴┐’¢║═╚▄ę║ė╔ė┌£žČ╚Ė─ūāŻ©╗“═¼Ģrėą╚▄ä®┴┐Ė─ūāŻ®�Ż¼╬÷│÷ĮY(ji©”)Š¦Ą─┴┐ĪŻŻ©5Ż®’¢║═╚▄ę║ųą╚▄ĮŌČ╚┼c╚▄┘|(zh©¼)Ą─┘|(zh©¼)┴┐ĘųöĄ(sh©┤)Ą─ōQ╦Ń�ĪŻ
ĪĪĪĪę╗Č©£žČ╚Ž┬��Ż¼─│’¢║═╚▄ę║╚▄┘|(zh©¼)Ą─╚▄ĮŌČ╚Ż║
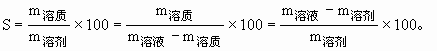
ĪĪĪĪĮŌŅ}Ģrę¬╩ņŠÜ▀\ė├Ž┬┴ą▒╚┴ąĻP(gu©Īn)ŽĄŻ║’¢║═╚▄ę║ųą

ĪĪĪ��ĪŻ©Č■Ż®ėąĻP(gu©Īn)┘|(zh©¼)┴┐ĘųöĄ(sh©┤)��Īó╬’┘|(zh©¼)Ą─┴┐ØŌČ╚Ą─ėŗ╦Ń
ĪĪĪĪėąĻP(gu©Īn)┘|(zh©¼)┴┐ĘųöĄ(sh©┤)Ą─ėŗ╦Ń▒╚▌^║åå╬Ż¼Ą½ūóęŌā╔³cŻ║ę╗╩Ū║¼ĮY(ji©”)Š¦╦«╗»║Ž╬’Ą─ØŌČ╚Š∙░┤¤o╦«╬’║¼┴┐ėŗ╦Ń�����Ż╗Č■╩Ūėąą®╚▄┘|(zh©¼)╚▄ĮŌ║¾┼c╦«░l(f©Ī)╔·┴╦Ę┤æ¬(y©®ng)Ż¼Ųõ▓╗─▄ų▒Įė░┤įŁ╬’┘|(zh©¼)Ą─┴┐▒Ē╩Š�Ż¼╚ńSO3����ĪóNa2O2╚▄ė┌╦«����Ż¼╚▄ę║ØŌČ╚░┤H2SO4�ĪóNaOH║¼┴┐ėŗ╦Ń���ĪŻ
ĪĪĪĪ┼c╬’┘|(zh©¼)Ą─┴┐ØŌČ╚ėąĻP(gu©Īn)Ą─ėŗ╦ŃėąŻ║Ż©1Ż®┼õųŲę╗Č©╬’┘|(zh©¼)Ą─┴┐ØŌČ╚╦∙ąĶ╚▄┘|(zh©¼)��Īó╚▄ä®┴┐╗“ØŌ╚▄ę║ŽĪßīė├┴┐Ą─ėŗ╦ŃŻ╗Ż©2Ż®Ė∙ō■(j©┤)╦∙╚▄╚▄┘|(zh©¼)Ą─┴┐Ū¾╦Ń╬’┘|(zh©¼)Ą─┴┐ØŌČ╚��Īóļxūė╬’┘|(zh©¼)Ą─┴┐ØŌČ╚��Ż╗Ż©3Ż®╬’┘|(zh©¼)Ą─┴┐ØŌČ╚┼c┘|(zh©¼)┴┐ĘųöĄ(sh©┤)Ą─ōQ╦Ń����ĪŻ
ĪĪĪĪČ■���Īó└²Ņ}Ęų╬÷
ĪĪĪĪ└²1ęčų¬─│’¢║═┬╚╗»Ōc╚▄ę║¾wĘe×ķVmL╚▄ę║├▄Č╚×ķdg/cm3Ż¼┘|(zh©¼)┴┐ĘųöĄ(sh©┤)×ķwŻź�Ż¼╬’┘|(zh©¼)Ą─┴┐ØŌČ╚×ķCmol/LŻ¼╚▄ę║ųą║¼NaClĄ─┘|(zh©¼)┴┐×ķmg���ĪŻ
ĪĪĪĪŻ©1Ż®ė├w▒Ē╩Šį┌įō£žČ╚Ž┬NaClĄ─╚▄ĮŌČ╚╩Ū____��ĪŻ
ĪĪĪ��ĪŻ©2Ż®ė├m����ĪóV▒Ē╩Š╚▄ę║Ą─╬’┘|(zh©¼)Ą─┴┐ØŌČ╚╩Ū____��ĪŻ
ĪĪĪ����ĪŻ©3Ż®ė├w��Īód▒Ē╩Š╚▄ę║Ą─╬’┘|(zh©¼)Ą─┴┐ØŌČ╚╩Ū____����ĪŻ
ĪĪĪ��ĪŻ©4Ż®ė├cĪód▒Ē╩Š╚▄ę║Ą─┘|(zh©¼)┴┐ĘųöĄ(sh©┤)╩Ū____��ĪŻ
ĪĪĪĪĮŌ╬÷Ż║▒ŠŅ}ø]ėąĮo│÷Š▀¾wöĄ(sh©┤)ųĄ�Ż¼ų╗Įo│÷│ķŽ¾Ę¹╠¢�����ĪŻ
ĪĪĪĪĮŌŅ}ĻP(gu©Īn)µI╩ŪŻ║ę╗ę¬£╩┤_░č╬š’¢║═╚▄ę║╚▄ĮŌČ╚��Īó┘|(zh©¼)┴┐ĘųöĄ(sh©┤)Ą─▒Š┘|(zh©¼)ģ^(q©▒)äe║═ŽÓ╗ź┬ō(li©ón)ŽĄ�����Ż¼Č■ę¬└ĒĮŌ├▄Č╚╩Ū┘|(zh©¼)┴┐ĘųöĄ(sh©┤)┼c╬’┘|(zh©¼)Ą─┴┐ØŌČ╚ŽÓ╗źōQ╦ŃĄ─ś“┴║ĪŻ
ĪĪĪ�����ĪŻ©1Ż®ę¬Ū¾░č’¢║═╚▄ę║Ą─┘|(zh©¼)┴┐ĘųöĄ(sh©┤)ōQ╦Ń×ķ╚▄ĮŌČ╚Ż║
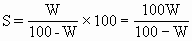
ĪĪĪ����ĪŻ©2Ż®ę¬Ū¾ė├VmL╚▄ę║ųąĄ─╚▄┘|(zh©¼)┘|(zh©¼)┴┐müĒ▒Ē╩Š╬’┘|(zh©¼)Ą─┴┐ØŌČ╚Ż║

ĪĪĪĪŻ©3Ż®ę¬Ū¾░č┘|(zh©¼)┴┐ĘųöĄ(sh©┤)Ż©WŻźŻ®ōQ╦Ń×ķ╬’┘|(zh©¼)Ą─┴┐ØŌČ╚Ż║
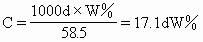
ĪĪĪ�ĪŻ©4Ż®ę¬Ū¾░č╬’┘|(zh©¼)Ą─┴┐ØŌČ╚ōQ╦Ń×ķ┘|(zh©¼)┴┐ĘųöĄ(sh©┤)�Ż¼īŹ┘|(zh©¼)╩ŪŻ©3Ż®ąĪŅ}Ą──µ▀\╦ŃŻ║
ĪĪĪĪ└²2ė├Na2SO3║═┴“Ę█į┌╦«╚▄ę║ųą╝ė¤ßĘ┤æ¬(y©®ng)Ż¼┐╔ųŲĄ├Na2S2O3�ĪŻ10Īµ║═70ĪµĢr�����Ż¼Na2S2O3į┌100g╦«ųąĄ─╚▄ĮŌČ╚Ęųäe×ķ60.0g║═212g�����ĪŻ│Ż£žŽ┬����Ż¼Å─╚▄ę║ųą╬÷│÷Ą─Š¦¾w╩ŪNa2S2O3·5H2O���ĪŻNa2S2O3į┌╦ßąį╚▄ę║ųą┴ó╝┤═Ļ╚½ĘųĮŌŻ║Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaClĪŻ¼F(xi©żn)╚Ī15.1gNa2SO3���Ż¼╚▄ė┌80.0mL╦«Ż¼┴Ē╚Ī5.00g┴“Ę█�����Ż¼ė├╔┘įSęę┤╝ØÖر║¾Ż©ęį▒Ń┴“─▄▒╗╦«Į■ØÖŻ®�����Ż¼╝ėĄĮ╔Ž╩÷╚▄ę║ųąĪŻė├ąĪ╗╝ė¤ßų┴╬óĘą�����Ż¼Ę┤æ¬(y©®ng)╝s1h║¾▀^×V����ĪŻ×Vę║į┌100ĪµĮø(j©®ng)š¶░l(f©Ī)����ĪóØŌ┐sĪó└õģsų┴10Īµ║¾╬÷│÷Na2S2O3·5H2OŠ¦¾w�����ĪŻ
ĪĪĪ���ĪŻ©1Ż®╚¶╝ė╚ļĄ─┴“Ę█▓╗ė├ęę┤╝ØÖر���Ż¼ī”Ę┤æ¬(y©®ng)Ą─ė░Ēæ╩Ū______�ĪŻŻ©╠Ņīæ▀xĒŚūų─ĖŻ®
ĪĪĪĪAŻ«Ģ■ĮĄĄ═Ę┤æ¬(y©®ng)╦┘┬╩BŻ«ąĶę¬╠ßĖ▀Ę┤æ¬(y©®ng)£žČ╚
ĪĪĪĪCŻ«īóį÷┤¾Ę┤æ¬(y©®ng)¾wŽĄĄ─pHDŻ«Ģ■£p╔┘«a(ch©Żn)┴┐
ĪĪĪ����ĪŻ©2Ż®Ę┤æ¬(y©®ng)1h║¾▀^×V�����Ż¼Ųõ─┐Ą─╩Ū_______����ĪŻ
ĪĪĪ�����ĪŻ©3Ż®×Vę║ųą│²Na2S2O3║═┐╔─▄╬┤Ę┤æ¬(y©®ng)═Ļ╚½Ą─Na2SO3═Ō�����Ż¼ūŅ┐╔─▄┤µį┌Ą─¤oÖCļs┘|(zh©¼)╩Ū_______����ĪŻ╦³╩Ūė╔_______«a(ch©Żn)╔·Ą─�ĪŻ╚ń╣¹×Vę║ųąįōļs┘|(zh©¼)Ą─║¼┴┐▓╗║▄Ą═�Ż¼ŲõÖz£yĄ─ĘĮĘ©╩ŪŻ║______��ĪŻ
ĪĪĪ�����ĪŻ©4Ż®įO(sh©©)Na2SO3Ė·┴“Ę█═Ļ╚½Ę┤æ¬(y©®ng)��Ż¼«öīó×Vę║š¶░l(f©Ī)ØŌ┐s║¾Ż¼└õģsų┴70Īµ���Ż¼╚▄ę║Ą─¾wĘe╝s30mL��Ż¼įō╚▄ę║╩Ūʱ▀_ĄĮ’¢║═��Ż┐įć═©▀^ėŗ╦Ńšf├„Ż©70ĪµĢrŻ¼Na2S2O3’¢║═╚▄ę║Ą─├▄Č╚×ķ1.17g/cm3Ż®�����ĪŻ
ĪĪĪ���ĪŻ©5Ż®╚¶ę¬ėŗ╦Ńį┌100ĪµŽ┬īó╚▄ę║š¶░l(f©Ī)ų┴¾wĘe×ķ30.0mLŻ¼į┘└õģsų┴10ĪµĢr╦∙─▄Ą├ĄĮĄ─Na2S2O3·5H2OĄ─┘|(zh©¼)┴┐�Ż¼─ŃšJ×ķ_______�����ĪŻŻ©╠Ņīæę╗éĆ▀xĒŚĄ─ūų─ĖŻ®
ĪĪĪĪAŻ«Ū░├µ╠ß╣®Ą─öĄ(sh©┤)ō■(j©┤)ęčĮø(j©®ng)ūŃē“
ĪĪĪĪBŻ«▀ĆąĶę¬╠ß╣®100ĪµĢr╚▄ę║Ą─├▄Č╚Ż©1.14g/cm3Ż®
ĪĪĪĪCŻ«▀ĆąĶę¬╠ß╣®ĮY(ji©”)Š¦║¾╩ŻėÓ╚▄ę║Ą─¾wĘeŻ©10.0mLŻ®
ĪĪĪ�ĪŻ©6Ż®Ė∙ō■(j©┤)Ą┌Ż©5Ż®ąĪŅ}─ŃĄ─▀xō±Ż©╚ń▀xAätų▒Įėėŗ╦Ń����Ż¼╚ń▀xB╗“Cät┐╔▀xė├ŲõöĄ(sh©┤)ō■(j©┤)Ż®���Ż¼ėŗ╦ŃÅ─10Īµ��Ż¼30.0mL╚▄ę║ųąĮY(ji©”)Š¦Č°│÷Ą─Na2S2O3·5H2OĄ─┘|(zh©¼)┴┐��ĪŻ
ĪĪĪĪĮŌ╬÷Ż║Ż©1Ż®┴“▓╗╚▄ė┌╦«��Ż¼╬ó╚▄ė┌ŠŲŠ½����ĪŻŅ}Įoą┼Žó“ė├ęę┤╝ØÖر║¾Ą─┴“─▄▒╗╦«Į■ØÖ”�Ż¼╚¶▓╗ė├ęę┤╝ØÖر┴“Ę█��Ż¼ät┴“▒ž╚╗┼c╦«╚▄ę║ųąĄ─Na2SO3“Įėė|▓╗┴╝”Č°ĮĄĄ═Ę┤æ¬(y©®ng)╦┘┬╩����Ż¼▓óĢ■£p╔┘«a(ch©Żn)┴┐����Ż¼┤░Ėæ¬(y©®ng)▀xA�ĪóDĪŻ
ĪĪĪ���ĪŻ©2Ż®Na2SO3+S=Na2S2O3
ĪĪĪĪn(S)=5/32=0.16(mol)Ż¼
ĪĪĪĪn(Na2SO3)=15.1/126=0.12(mol)
ĪĪĪĪ┴“Ę█▀^┴┐���ĪŻĘ┤æ¬(y©®ng)1h║¾▀^×VŻ¼Ųõ─┐Ą─╩Ū│²╚ź▀^┴┐Ą─┴“Ę█�����ĪŻ
ĪĪĪ����ĪŻ©3Ż®ė╔ė┌Na2SO3▓╗ĘĆ(w©¦n)Č©��Ż¼į┌│©ķ_╚▌Ų„ųąė┌100Īµ╚▄ę║ųą▒Ż│ųĘą“vŽ┬Ę┤æ¬(y©®ng)ķL▀_1h�Ż¼║▄╚▌ęū▒╗┐šÜŌč§╗»│╔Na2SO4�����ĪŻ

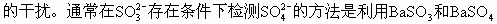
ĪĪĪĪČ╝▓╗╚▄ė┌╦«����Ż¼Ą½BaSO3╚▄ė┌╦ßČ°BaSO4▓╗╚▄ė┌╦߯¼╝ėŽĪHCl╝┤┐╔Öz£y│÷�ĪŻ
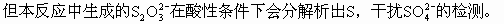
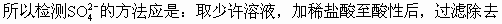
ĪĪĪĪS�Ż¼į┘╝ėBaCl2╚▄ę║�ĪŻ
ĪĪĪĪŻ©4Ż®Ż©ĮŌĘ©ę╗Ż®ėŗ╦Ń╔·│╔Ą─Na2S2O3į┌70ĪµĢr’¢║═╚▄ę║æ¬(y©®ng)ėąĄ─¾wĘe����Ż¼īó╦³Ė·Ņ}įO(sh©©)30mLŽÓ▒╚▌^�ĪŻ
ĪĪĪĪ╚¶Ę┤æ¬(y©®ng)Ą├ĄĮĄ─Na2S2O3į┌70ĪµĢr┼õ│╔’¢║═╚▄ę║��Ż¼Ųõ¾wĘe×ķx���Ż¼ät
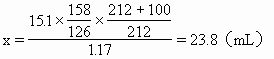
ĪĪĪĪę“23.8mLŻ╝30mL╦∙ęįš¶░l(f©Ī)║¾Ą─╚▄ę║╔ą╬┤▀_ĄĮ’¢║═�����ĪŻ
ĪĪĪ��ĪŻ©ĮŌĘ©Č■Ż®ėŗ╦Ń70ĪµĢr30mL’¢║═╚▄ę║ųąæ¬(y©®ng)║¼Na2S2O3Ą─┘|(zh©¼)┴┐�����Ż¼īó╦³Ė·Ę┤æ¬(y©®ng)Ą├ĄĮĄ─Na2S2O3Ą─┘|(zh©¼)┴┐ŽÓ▒╚▌^���ĪŻ
ĪĪĪĪ╚¶įō╚▄ę║╩Ū’¢║═╚▄ę║Ż¼Ųõ╦∙║¼Na2S2O3Ą─┘|(zh©¼)┴┐×ķx�Ż¼ät
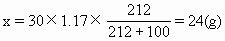
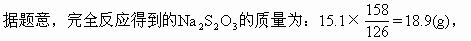
ĪĪĪĪ18.9gŻ╝24g��Ż¼╚▄ę║╔ą╬┤▀_ĄĮ’¢║═����ĪŻ
ĪĪĪ���ĪŻ©5Ż®Ū░Ņ}ųąęčų¬╔·│╔Ą─Na2S2O3Ą─┘|(zh©¼)┴┐×ķ18.9gŻ¼╚ń╣¹ę¬Ū¾Ą├10ĪµĢr30mL╚▄ę║╦∙╬÷│÷Ą─Na2S2O3·5H2OĄ─┘|(zh©¼)┴┐��Ż¼▀Ćæ¬(y©®ng)įōų¬Ą└╚▄ę║ųą╦«Ą─┘|(zh©¼)┴┐�����Ż¼Č°╚▄ę║ųą╦«Ą─┘|(zh©¼)┴┐=╚▄ę║┘|(zh©¼)┴┐ŻŁNa2S2O3Ą─┘|(zh©¼)┴┐��Ż¼╚▄ę║Ą─┘|(zh©¼)┴┐=╚▄ę║Ą─¾wĘeŻ©30mLŻ®×╚▄ę║Ą─├▄Č╚���ĪŻę“┤╦Ż¼▀ĆąĶę¬ų¬Ą└100ĪµĢr╚▄ę║Ą─├▄Č╚���Ż¼æ¬(y©®ng)▀xBĒŚĪŻ
ĪĪĪ��ĪŻ©6Ż®įO(sh©©)Ę┤æ¬(y©®ng)Ą├ĄĮĄ─Na2S2O3·5H2OĄ─┘|(zh©¼)┴┐×ķx��Ż¼ätxųąNa2S2O3
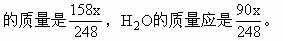
ĪĪĪĪ╚▄ę║ųą╦«Ą─┘|(zh©¼)┴┐=30×1.14-18.9=15.3(g)
ĪĪĪĪĖ∙ō■(j©┤)10ĪµĢrĄ─╚▄ĮŌČ╚����Ż¼╬÷│÷Š¦¾w║¾Ą─╚▄ę║ę╗Č©╩Ū’¢║═╚▄ę║���Ż¼ätėą

ĪĪĪĪĮŌĄ├Ż║x=23.2Ż©gŻ®
ĪĪĪĪ╚²���ĪóŠÜ┴Ģ(x©¬)┼cÖz£y
ĪĪĪĪ1Ż«tĪµĢr����Ż¼Na2CO3Ą─╚▄ĮŌČ╚×ķAg���Ż¼¼F(xi©żn)ėą’¢║═Na2CO3╚▄ę║Ż©100+AŻ®gŻ¼Ųõ╚▄┘|(zh©¼)Ą─┘|(zh©¼)┴┐ĘųöĄ(sh©┤)×ķaŻź���Ż¼Ž“╚▄ę║ųą═Č╚ļ¤o╦«Na2CO3╣╠¾wAgŻ¼ņoų├║¾╬÷│÷╔┘┴┐Š¦¾wŻ©Na2CO3·10H2OŻ®�Ż¼╝ė╦«╩╣Š¦¾w╚½▓┐╚▄ĮŌ�Ż¼╦∙Ą├╚▄ę║╚į×ķ’¢║═╚▄ę║Ż¼╝ė╚ļĄ─╦«╩Ū[]
ĪĪĪĪAŻ«100gBŻ«(100+A)g

ĪĪĪĪ2Ż«ėąX��ĪóY���ĪóZ╚²ĘN¹}���Ż¼ęčų¬Ż║
ĪĪĪ�����ĪŻ©1Ż®25ĪµĢr���Ż¼X’¢║═╚▄ę║Ųõ╚▄┘|(zh©¼)┘|(zh©¼)┴┐ĘųöĄ(sh©┤)×ķ15ŻźŻ╗
ĪĪĪ�����ĪŻ©2Ż®25ĪµĢr���Ż¼į┌100g┘|(zh©¼)┴┐ĘųöĄ(sh©┤)×ķ10ŻźĄ─Y╚▄ę║ųą╝ė╚ļ5gYŻ©¤o╦«¹}Ż®║¾��Ż¼ŪĪ║├▀_ĄĮ’¢║═��Ż╗
ĪĪĪ��ĪŻ©3Ż®25ĪµĢr�����Ż¼īóę╗Č©┴┐Z╚▄ę║š¶░l(f©Ī)Ą¶5.75g╦«į┘╗ųÅ═(f©┤)ĄĮ25Īµ���Ż¼╗“▒Ż│ųį┌25ĪµŽ“Ųõųą╝ė╚ļ6.3gZĄ─ĮY(ji©”)Š¦╦«║Ž╬’Ż©Z·9H2OŻ¼─”Ā¢┘|(zh©¼)┴┐=240Ż®Ż¼Č╝ŪĪ║├ą╬│╔’¢║═╚▄ę║���ĪŻ
ĪĪĪĪät25ĪµĢr��Ż¼XĪóY��ĪóZĄ─╚▄ĮŌČ╚Ż©ųĖ¤o╦«¹}Ż®┤¾ąĪĒśą“š²┤_Ą─╩Ū[]
ĪĪĪĪAŻ«XŻŠYŻŠZBŻ«ZŻŠYŻŠX
ĪĪĪĪCŻ«YŻŠZŻŠXDŻ«ZŻŠXŻŠY
ĪĪĪĪ3Ż«╚Ī50mL2mol/LĄ─┴“╦ß╚▄ę║�����Ż¼Ė·6.5gĮī┘õ\│õĘųĘ┤æ¬(y©®ng)�Ż¼╝ė¤ßš¶░l(f©Ī)16.2g╦«���Ż¼▓ó└õģsų┴10ĪµĢrŻ¼┐╔╬÷│÷ZnSO4·7H2OČÓ╔┘┐╦Ż©10ĪµĢrZnSO4╚▄ĮŌČ╚×ķ32g�����Ż¼┴“╦ß├▄Č╚1.12g/cm3Ż®�����Ż┐
ĪĪĪĪ4Ż«A�����ĪóBā╔ĘN╗»║Ž╬’Ą─╚▄ĮŌČ╚Ū·ŠĆ╚ńŽ┬łD╦∙╩ŠŻ¼¼F(xi©żn)ę¬ė├ĮY(ji©”)Š¦Ę©Å─A��ĪóB╗ņ║Ž╬’ųą╠ß╚ĪAŻ©▓╗┐╝æ]A���ĪóB╣▓┤µĢrŻ¼ī”Ė„ūį╚▄ĮŌČ╚Ą─ė░ĒæŻ®
ĪĪĪ����ĪŻ©1Ż®╚Ī50g╗ņ║Ž╬’����Ż¼īó╦³╚▄ė┌100g¤ß╦«Ż¼╚╗║¾└õģsų┴20ĪµĪŻ╚¶ę¬╩╣A╬÷│÷Č°B▓╗╬÷│÷���Ż¼ät╗ņ║Ž╬’ųąBĄ─┘|(zh©¼)┴┐ĘųöĄ(sh©┤)Ż©BŻźŻ®ūŅĖ▀▓╗─▄│¼▀^ČÓ╔┘Ż┐Ż©īæ│÷═Ų└Ē╝░ėŗ╦Ń▀^│╠Ż®
ĪĪĪ���ĪŻ©2Ż®╚ĪWg╗ņ║Ž╬’Ż¼īó╦³╚▄ė┌100g¤ß╦«��Ż¼╚╗║¾└õģsų┴10ĪµĪŻ╚¶╚įę¬╩╣A╬÷│÷Č°B▓╗╬÷│÷�Ż¼šłīæ│÷į┌Ž┬┴ąā╔ĘNŪķørŽ┬��Ż¼╗ņ║Ž╬’ųąAĄ─┘|(zh©¼)┴┐ĘųöĄ(sh©┤)Ż©AŻźŻ®æ¬(y©®ng)ØMūŃ╩▓├┤ĻP(gu©Īn)ŽĄ╩Į���Ż┐Ż©ęįWĪóa�����Īób▒Ē╩Š����Ż¼ų╗ąĶīó┤░Ė╠Ņīæį┌Ž┬┴ąÖMŠĆĄ─┐š░ū╠ÄĪŻŻ®
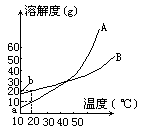
ĪĪĪĪ«öwŻ╝a+bĢr____
ĪĪĪĪ«öwŻŠa+bĢr____
ĪĪĪĪ5Ż«│Ż£žŽ┬A║═Bā╔ĘNÜŌ¾wĮM│╔╗ņ║Ž╬’ÜŌ¾wŻ©AĄ─ŽÓī”Ęųūė┘|(zh©¼)┴┐┤¾ė┌BĄ─ŽÓī”Ęųūė┘|(zh©¼)┴┐Ż®��Ż¼Įø(j©®ng)Ęų╬÷�Ż¼╗ņ║ŽÜŌ¾wųąų╗║¼ėąĄ¬║═Üõā╔ĘNį¬╦ž�Ż╗Č°Ūę��Ż¼▓╗šōA║═Bęį║╬ĘN▒╚└²╗ņ║Ž���Ż¼Ą¬║═ÜõĄ─┘|(zh©¼)┴┐▒╚┐é┤¾ė┌14/3ĪŻė╔┤╦┐╔┤_Č©A×ķ____����Ż¼B×ķ____ĪŻŲõ└Ēė╔╩Ū____���ĪŻ╚¶╔Ž╩÷╗ņ║ŽÜŌ¾wųąĄ¬║═ÜõĄ─┘|(zh©¼)┴┐▒╚×ķ7Ī├1Ż¼ätį┌╗ņ║ŽÜŌ¾wųąA║═BĄ─╬’┘|(zh©¼)Ą─┴┐ų«▒╚×ķ____�Ż╗Aį┌╗ņ║ŽÜŌ¾wųąĄ─¾wĘeĘųöĄ(sh©┤)×ķ____Żź�ĪŻ
ĪĪĪĪ║åå╬┤░Ė
ĪĪĪĪ1Ż«AŻ╗2Ż«D����Ż╗3Ż«15.5g����Ż╗
ĪĪĪĪ4Ż«Ż©1Ż®į┌20ĪµĢrŻ¼╚¶ę¬B▓╗╬÷│÷�Ż¼įō╚▄ę║ųąBĄ─┘|(zh©¼)┴┐▓╗─▄│¼▀^20g���Ż¼ė╔ė┌A�����ĪóB┘|(zh©¼)┴┐╣▓50g��Ż¼╦∙ęį▀@ĢrAĄ─┘|(zh©¼)┴┐│¼▀^30g��Ż¼┤¾ė┌╦³Ą─╚▄ĮŌČ╚�Ż¼A╬÷│÷�Ż¼Ę¹║ŽŅ}ęŌĪŻ╝┤50g×BŻź≤20g��Ż¼BŻź≤40Żź��ĪŻ
ĪĪĪĪŻ©2Ż®«öWŻ╝a+bĢr����Ż¼AŻźŻŠa/w�����Ż╗«öWŻŠa+bĢr�Ż¼AŻź≥W-b/WŻ╗
ĪĪĪĪ5Ż«NH3N2╝āNH3ÜŌ¾wųąĄ¬║═ÜõĄ─┘|(zh©¼)┴┐▒╚×ķ14/3���Ż¼į┌╝āNH3ųą╗ņ╚ļ╚╬║╬▒╚└²Ą─N2Č╝īó╩╣Ą¬║═ÜõĄ─┘|(zh©¼)┴┐▒╚┤¾ė┌14/34Ī├180ŻźĪŻ
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖCĪóŲĮ░ÕĄ╚ęŲäėįO(sh©©)éõįLå¢ųą┐╝ŠW(w©Żng)�����Ż¼2024ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąąŻĪ>>³cō¶▓ķ┐┤









