┐╝³c(di©Żn)1.Įī┘▓─┴Ž
1. Įī┘▓─┴Ž░³└©╝āĮī┘(90ČÓĘN)║═║ŽĮ(ÄūŪ¦ĘN)ā╔ŅÉ�ĪŻ
Įī┘ī┘ė┌Įī┘▓─┴Ž�����Ż¼Ą½Įī┘▓─┴Ž▓╗ę╗Č©╩Ū╝āĮī┘����Ż¼ę▓┐╔─▄╩Ū║ŽĮ���ĪŻ
2. Įī┘ųŲŲĘ╩Ūė╔Įī┘▓─┴ŽųŲ│╔Ą─��Ż¼ĶF���ĪóŃ~ĪóõX╝░Ųõ║ŽĮ╩Ū╚╦ŅÉ╩╣ė├ūŅČÓĄ─Įī┘▓─┴Ž��ĪŻ
┐╝³c(di©Żn)2. Įī┘▓─┴ŽĄ─░l(f©Ī)š╣╩Ę
Ė∙ō■(j©┤)Üv╩ĘĄ─īW(xu©”)┴Ģ(x©¬)�����Ż¼╬ęéā┐╔ęįų¬Ą└Įī┘▓─┴ŽĄ─░l(f©Ī)š╣▀^(gu©░)│╠���ĪŻ╔╠│»�����Ż¼╚╦éāķ_(k©Īi)╩╝╩╣ė├ŪÓŃ~Ų„;┤║Ū’Ģr(sh©¬)Ų┌ķ_(k©Īi)╩╝ę▒ĶF;æ(zh©żn)ć°(gu©«)Ģr(sh©¬)Ų┌ķ_(k©Īi)╩╝¤Æõō;Ń~║═ĶFę╗ų▒╩Ū╚╦ŅÉÅVĘ║æ¬(y©®ng)ė├Ą─Įī┘▓─┴Ž���ĪŻį┌100ČÓ─ĻŪ░Ż¼ėųķ_(k©Īi)╩╝┴╦õXĄ─╩╣ė├��Ż¼ę“õXŠ▀ėą├▄Č╚ąĪ║═┐╣Ė»╬gĄ╚įSČÓā×(y©Łu)┴╝ąį─▄�����Ż¼õXĄ─«a(ch©Żn)┴┐ęč│¼▀^(gu©░)┴╦Ń~�����Ż¼╬╗ė┌Ą┌Č■╬╗����ĪŻ
Įī┘ĘųŅÉŻ║ųžĮī┘Ż║╚ńŃ~Īóõ\����ĪóŃUĄ╚
▌pĮī┘Ż║╚ńŌcĪóµV����ĪóõXĄ╚;║┌╔½Įī┘Ż║═©│ŻųĖĶF�����ĪóÕi���ĪóŃt╝░╦³éāĄ─║ŽĮĪŻFe��ĪóMn�ĪóCr(Ńt)ėą╔½Įī┘Ż║═©│Ż╩ŪųĖ│²║┌╔½Įī┘ęį═ŌĄ─Ųõ╦¹Įī┘ĪŻ
┐╝³c(di©Żn)3 Įī┘Ą─╬’└Ēąį┘|(zh©¼)
1.╣▓ąįŻ║┤¾ČÓöĄ(sh©┤)Įī┘Č╝Š▀ėąĮī┘╣ŌØ╔���Ż¼├▄Č╚║═ė▓Č╚▌^┤¾��Ż¼╚█Ęą³c(di©Żn)▌^Ė▀�����Ż¼Š▀ėą┴╝║├Ą─čėš╣ąį║═ī¦(d©Żo)ļŖ�Īóī¦(d©Żo)¤ßąį��Ż¼į┌╩ę£žŽ┬│²╣»×ķę║¾w�����Ż¼ŲõėÓĮī┘Š∙×ķ╣╠¾wĪŻ
(1)│Ż£žŽ┬ę╗░Ń×ķ╣╠æB(t©żi)(╣»×ķę║æB(t©żi))��Ż¼ėąĮī┘╣ŌØ╔�ĪŻ
(2)┤¾ČÓöĄ(sh©┤)│╩Ńy░ū╔½(Ń~×ķūŽ╝t╔½Ż¼Į×ķ³S╔½)
(3)ėą┴╝║├Ą─ī¦(d©Żo)¤ßąį���Īóī¦(d©Żo)ļŖąįĪóčėš╣ąį
2.ę╗ą®Įī┘Ą─╠žąįŻ║ĶF����ĪóõXĄ╚┤¾ČÓöĄ(sh©┤)Įī┘Č╝│╩Ńy░ū╔½Ż¼Ń~│╩ūŽ╝t╔½���Ż¼Į│╩³S╔½;│Ż£žŽ┬┤¾ČÓöĄ(sh©┤)Įī┘Č╝╩Ū╣╠¾w����Ż¼╣»ģs╩Ūę║¾w;Ė„ĘNĮī┘Ą─ī¦(d©Żo)ļŖąį��Īóī¦(d©Żo)¤ßąį���Īó├▄Č╚����Īó╚█³c(di©Żn)Īóė▓Č╚Ą╚▓Ņ«É▌^┤¾;ŃyĄ─ī¦(d©Żo)ļŖąį║═ī¦(d©Żo)¤ßąįūŅ║├�����Ż¼õ~Ą─├▄Č╚ūŅ┤¾�����Ż¼õćĄ─├▄Č╚ūŅąĪ�����Ż¼µuĄ─╚█³c(di©Żn)ūŅĖ▀�����Ż¼╣»Ą─╚█³c(di©Żn)ūŅĄ═����Ż¼ŃtĄ─ė▓Č╚ūŅ┤¾ĪŻ
(1)õXŻ║ĄžÜżųą║¼┴┐ūŅČÓĄ─Įī┘į¬╦ž(1)Ō}Ż║╚╦¾wųą║¼┴┐ūŅČÓĄ─Įī┘į¬╦ž(1)ĶFŻ║─┐Ū░╩└Įń─Ļ«a(ch©Żn)┴┐ūŅČÓĄ─Įī┘(ĶF>õX>Ń~)(1)ŃyŻ║ī¦(d©Żo)ļŖ���Īóī¦(d©Żo)¤ßąįūŅ║├Ą─Įī┘(Ńy>Ń~>Į>õX)
(1)ŃtŻ║ė▓Č╚ūŅĖ▀Ą─Įī┘(1)µuŻ║╚█³c(di©Żn)ūŅĖ▀Ą─Įī┘(1)╣»Ż║╚█³c(di©Żn)ūŅĄ═Ą─Įī┘(1)õ~Ż║├▄Č╚ūŅ┤¾Ą─Įī┘(1)õć Ż║├▄Č╚ūŅąĪĄ─Įī┘
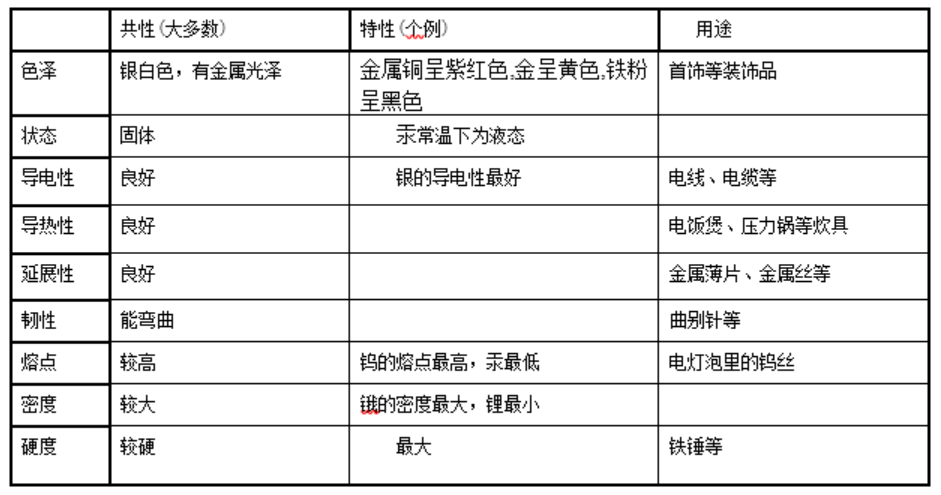
Öz£y(c©©)ę╗Ż║Įī┘▓─┴Ž1.Įī┘Ą─╬’└Ēąį┘|(zh©¼)
┐╝³c(di©Żn)4.╬’┘|(zh©¼)Ą─ąį┘|(zh©¼)┼c╬’┘|(zh©¼)Ą─ė├═Šų«ķgĄ─ĻP(gu©Īn)ŽĄ
1.╬’┘|(zh©¼)Ą─ąį┘|(zh©¼)øQČ©╬’┘|(zh©¼)Ą─ė├═Š����Ż¼Č°╬’┘|(zh©¼)Ą─ė├═ŠėųĘ┤ė││÷╬’┘|(zh©¼)Ą─ąį┘|(zh©¼)ĪŻ
2.╬’┘|(zh©¼)Ą─ąį┘|(zh©¼)║▄┤¾│╠Č╚╔ŽøQČ©┴╦╬’┘|(zh©¼)Ą─ė├═Š�ĪŻ
Ą½▀@▓╗╩Ū╬©ę╗Ą─øQČ©ę“╦žŻ¼į┌┐╝æ]╬’┘|(zh©¼)Ą─ė├═ŠĢr(sh©¬)��Ż¼▀ĆąĶę¬┐╝æ]ār(ji©ż)Ė±���Īó┘Yį┤����Īó╩Ūʱ├└ė^��Īó╩╣ė├╩Ūʱ▒Ń└¹��Ż¼ęį╝░ÅU┴Ž╩Ūʱęūė┌╗ž╩š║═ī”(du©¼)Łh(hu©ón)ŠoĄ─ė░ĒæĄ╚ČÓĘNę“╦ž�ĪŻ
┐╝³c(di©Żn)5.║ŽĮ
1.║ŽĮŻ║ė╔ę╗ĘNĮī┘Ė·Ųõ╦¹ę╗ĘN╗“ÄūĘNĮī┘(╗“Įī┘┼cĘŪĮī┘)ę╗Ų╚█║ŽČ°│╔Ą─Š▀ėąĮī┘╠žąįĄ─╬’┘|(zh©¼)�����ĪŻį┌Įī┘ųą╝ė¤ß╚█║Ž─│ą®Įī┘║═ĘŪĮī┘�����Ż¼ą╬│╔Š▀ėąĮī┘╠žąįĄ─╬’┘|(zh©¼)ĪŻ
Ī’Ż║ę╗░Ńšf(shu©Ł)üĒ(l©ói)�Ż¼║ŽĮĄ─╚█³c(di©Żn)▒╚Ė„│╔ĘųĄ═Ż¼ė▓Č╚▒╚Ė„│╔Ęų┤¾����Ż¼┐╣Ė»╬gąį─▄Ė³║├ĪŻ
ūóęŌŻ║(1)║ŽĮ╩ŪĮī┘┼cĮī┘╗“Įī┘┼cĘŪĮī┘Ą─╗ņ║Ž╬’�����ĪŻ(2)║ŽĮĄ─║▄ČÓąį─▄┼cĮM│╔╦³éāĄ─╝āĮī┘▓╗═¼��Ż¼╩╣║ŽĮĖ³╚▌ęū▀mė┌▓╗═¼Ą─ė├═Š���ĪŻ(3)╚š│Ż╩╣ė├Ą─Įī┘▓─┴Ž��Ż¼┤¾ČÓöĄ(sh©┤)×ķ║ŽĮ��ĪŻ(4)Įī┘į┌╚█║Ž┴╦Ųõ╦³Įī┘║═ĘŪĮī┘║¾����Ż¼▓╗āHĮM│╔╔Ž░l(f©Ī)╔·┴╦ūā╗»��Ż¼Ųõā╚(n©©i)▓┐ĮM│╔ĮY(ji©”)śŗ(g©░u)ę▓░l(f©Ī)╔·┴╦Ė─ūā�����Ż¼Å─Č°ę²Ųąį┘|(zh©¼)Ą─ūā╗»ĪŻ
2.║ŽĮĄ─ą╬│╔Śl╝■Ż║Ųõųą╚╬ę╗Įī┘Ą─╚█³c(di©Żn)▓╗─▄Ė▀ė┌┴Ēę╗Įī┘Ą─Ęą³c(di©Żn)(«ö(d©Īng)ā╔ĘNĮī┘ą╬│╔║ŽĮĢr(sh©¬))�ĪŻ
3.║ŽĮ┼cĮM│╔╦³éāĄ─╝āĮī┘ąį┘|(zh©¼)▒╚▌^:

Ž┬├µ╩Ū³SŃ~║═Ń~Ų¼Ż¼║ĖÕa║═Õa�����Ż¼õX║ŽĮ║═õXŠĆĄ─ėąĻP(gu©Īn)ąį┘|(zh©¼)▒╚▌^Ż║ 4.ÄūĘN│ŻęŖ(ji©żn)║ŽĮ
(1)ĶF║ŽĮŻ║ų„ę¬░³└©╔·ĶF║═õō�Ż¼╦³éāĄ─ģ^(q©▒)äe╩Ū║¼╠╝┴┐▓╗═¼Ż¼╔·ĶF║¼╠╝┴┐2%-4.3%�Ż¼õōĄ─║¼╠╝┴┐×ķ0.03%—2%ĪŻõō▒╚╔·ĶFŠ▀ėąĖ³ČÓĄ─ā×(y©Łu)┴╝ąį─▄����Ż¼ęūė┌╝ė╣ż�Ż¼ė├═ŠĖ³×ķÅVĘ║ĪŻ▓╗õPõōŻ║║¼Ńt����ĪóµćĄ─õō
(2)õX║ŽĮŻ║õXųą╝ė╚ļµVĪóŃ~�Īóõ\Ą╚Įī┘ą╬│╔║ŽĮĪŻÅVĘ║æ¬(y©®ng)ė├ė┌ųŲįņ’wÖC(j©®)��Īó┼×═¦║═▌dųžŲ¹▄ćĄ╚Ż¼┐╔į÷╝ė╦³éāĄ─▌dųž┴┐ęį╝░╠ßĖ▀▀\(y©┤n)ąą╦┘Č╚�Ż¼▓óŠ▀ėą┐╣║Ż╦«Ė»╬gĪó▒▄┤┼ąįĄ╚╠ž³c(di©Żn)����ĪŻ
(3)Ń~║ŽĮŻ║³SŃ~Ż║Ń~Īóõ\Ą─║ŽĮ;ŪÓŃ~Ż║Ń~����ĪóÕaĄ─║ŽĮ;░ūŃ~Ż║Ń~ĪóµćĄ─║ŽĮ��ĪŻ
(4)Ōü║═Ōü║ŽĮŻ║▒╗šJ(r©©n)×ķ╩Ū21╩└╝o(j©¼)Ą─ųžę¬Įī┘▓─┴Ž��Ż¼Ōü║ŽĮ┼c╚╦¾wėą║▄║├Ą─“ŽÓ╚▌ąį”��Ż¼ ę“┤╦┐╔ė├üĒ(l©ói)ųŲįņ╚╦įņ╣ŪĄ╚����ĪŻ
ā×(y©Łu)³c(di©Żn)Ż║ó┘╚█³c(di©Żn)Ė▀Īó├▄Č╚ą��Īó┌┐╔╦▄ąį║├����Īóęūė┌╝ė╣ż�ĪóÖC(j©®)ąĄąį─▄║├ó█┐╣Ė»╬gąį─▄║├
ąį┘|(zh©¼)Ż║ā×(y©Łu)«ÉĄ──═Ė»╬gąį����Ż¼ī”(du©¼)║Ż╦«Īó┐šÜŌ║═╚¶Ė╔Ė»╬gĮķ┘|(zh©¼)Č╝ĘĆ(w©¦n)Č©���Ż¼┐╔╦▄ąį║├�Ż¼ÅŖ(qi©óng)Č╚┤¾��Ż¼ėą├▄Č╚ąĪ��Ż¼ėųĘQėH╔·╬’Įī┘�����ĪŻ
ė├═ŠŻ║ćŖÜŌ╩Į░l(f©Ī)äė(d©░ng)ÖC(j©®)�Īó’wÖC(j©®)ÖC(j©®)╔ĒĪó╚╦įņąl(w©©i)ąŪ═ŌÜż�Īó╗╝²Üż¾w��Īóßt(y©®)īW(xu©”)ča(b©│)ą╬�Īóįņ╝łĪó╚╦įņ╣Ū����Īó║Ż╦«ĄŁ╗»įO(sh©©)éõ��Īó║Ż▌å���Īó┼×═¦Ą─═ŌÜżĄ╚ĪŻ
┐╝³c(di©Żn)6.Įī┘┼cč§ÜŌĄ─Ę┤æ¬(y©®ng)
Įī┘Ą─╗»īW(xu©”)ąį┘|(zh©¼)Ż║1.┤¾ČÓöĄ(sh©┤)Įī┘┐╔┼cč§ÜŌĄ─Ę┤æ¬(y©®ng)
2.Įī┘+╦ß→¹}+H2↑
3.Įī┘ + ¹} → ┴Ēę╗Įī┘ + ┴Ēę╗¹} (Śl╝■Ż║“Ū░ōQ║¾����Ż¼¹}┐╔╚▄”)
Fe+CuSO4==Cu+FeSO4(“Ø±Ę©ę▒Į”įŁ└Ē )
┐╝³c(di©Żn)7.Įī┘┼c╦ߥ─Ę┤æ¬(y©®ng)
┐╝³c(di©Żn)8.Įī┘┼c╗»║Ž╬’╚▄ę║Ą─Ę┤æ¬(y©®ng)

┐╝³c(di©Żn)9.ų├ōQĘ┤æ¬(y©®ng)
ų├ōQĘ┤æ¬(y©®ng)Ż║ė╔ę╗ĘNå╬┘|(zh©¼)┼cę╗ĘN╗»║Ž╬’Ę┤æ¬(y©®ng)Ż¼╔·│╔┴Ēę╗ĘNå╬┘|(zh©¼)┼c╗»║Ž╬’Ą─Ę┤æ¬(y©®ng)Įąū÷ų├ōQĘ┤æ¬(y©®ng)���ĪŻ
┐╝³c(di©Żn)10.Įī┘╗Ņäė(d©░ng)ąįĒśą“
╚╦éā═©▀^(gu©░)┤¾┴┐Ą─īŹ(sh©¬)“×(y©żn)“×(y©żn)ūCĄ├ĄĮ│ŻęŖ(ji©żn)Įī┘Ą─╗Ņäė(d©░ng)ąįĒśą“Ż║
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
Įī┘╗Ņäė(d©░ng)ąįŻ║ė╔ÅŖ(qi©óng)ĄĮ╚§
æ¬(y©®ng)ė├Ż║į┌Įī┘╗Ņäė(d©░ng)ąįĒśą“└’���Ż¼Įī┘Ą─╬╗ų├įĮ┐┐Ū░Ż¼╦³Ą─╗Ņäė(d©░ng)ąįįĮÅŖ(qi©óng)�����ĪŻ
(1)į┌Įī┘╗Ņäė(d©░ng)ąįĒśą“└’���Ż¼╬╗ė┌ÜõŪ░├µĄ─Įī┘─▄ų├ōQ│÷¹}╦ß��ĪóŽĪ┴“╦ßųąĄ─Üõ(▓╗┐╔ė├ØŌ┴“╦ß�ĪóŽ§╦ß)ĪŻ
(2)į┌Įī┘╗Ņäė(d©░ng)ąįĒśą“└’���Ż¼╬╗ė┌Ū░├µĄ─Įī┘─▄░č╬╗ė┌║¾├µĄ─Įī┘?g©░u)─╦³éā╗»║Ž╬’Ą─╚▄ę║└’ų├ōQ│÷üĒ(l©ói)(K����ĪóCa�����ĪóNa│²═Ō)�ĪŻ
┐╝³c(di©Żn)11.ĄV╩»
1. Įī┘┘Yį┤Ą─┤µį┌ĘĮ╩ĮŻ║ĄžŪ“╔ŽĄ─Įī┘┘Yį┤ÅVĘ║┤µį┌ė┌ĄžÜż║═║Żč¾ųąŻ¼┤¾ČÓöĄ(sh©┤)Įī┘╗»║Ž╬’ąį┘|(zh©¼)▌^╗ŅØŖ���Ż¼╦∙ęį╦³éāęį╗»║Ž╬’Ą─ą╬╩Į┤µį┌;ų╗ėą╔┘öĄ(sh©┤)Įī┘╗»īW(xu©”)ąį┘|(zh©¼)║▄▓╗╗ŅØŖ��Ż¼╚ńĮ�ĪóŃyĄ╚ęįå╬┘|(zh©¼)ą╬╩Į┤µį┌�����ĪŻ
2. ĄV╩»Ż║╣żśI(y©©)╔Ž░č─▄╠ߤÆĮī┘Ą─ĄV╬’ĮąĄV╩»���ĪŻ

3. │ŻęŖ(ji©żn)ĄV╩»├¹ĘQ┼cŲõų„ę¬│╔ĘųŻ║
┐╝³c(di©Żn)12.ę╗č§╗»╠╝▀ĆįŁč§╗»ĶF
(1)āxŲ„Ż║ĶF╝▄┼_(t©ói)(2éĆ(g©©))��Īóė▓┘|(zh©¼)▓Ż┴¦╣▄����Īóå╬┐ūŽŲż┘É(2éĆ(g©©))���ĪóŠŲŠ½¤¶��Īóįć╣▄����ĪóŠŲŠ½ćŖ¤¶�����Īóļp┐ūŽŲż┘É���Īóī¦(d©Żo)ÜŌ╣▄����ĪŻ
(2)╦ÄŲĘŻ║č§╗»ĶFĘ█─®����Īó│╬ŪÕ╩»╗ę╦«���Īóę╗č§╗»╠╝?x©¼)Ō¾w
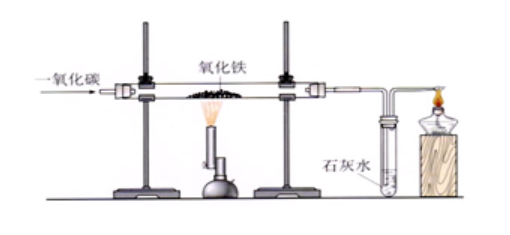
(3)čbų├łDŻ║
(4)▓Į¾EŻ║ó┘Öz“×(y©żn)čbų├Ą─ÜŌ├▄ąį;ó┌čb╚ļ╦ÄŲĘ▓ó╣╠Č©;ó█Ž“▓Ż┴¦╣▄ā╚(n©©i)═©╚ļę╗č§╗»╠╝?x©¼)Ō¾w;ó▄Įoč§╗»ĶF╝ė¤ß;ó▌═Żų╣╝ė¤ß;ó▐═Żų╣═©╚ļę╗č§╗»╠╝
(5)¼F(xi©żn)Ž¾Ż║╝t╔½Ę█─®ųØuūā│╔║┌╔½Ż¼│╬ŪÕ╩»╗ę╦«ūā£åØß�����Ż¼╬▓ÜŌ╚╝¤²«a(ch©Żn)╔·╦{(l©ón)╔½╗čµ���ĪŻ
(6)╗»īW(xu©”)ĘĮ│╠╩ĮŻ║3CO+Fe2O3==Ė▀£ž==2Fe+3CO22CO+O2==³c(di©Żn)╚╝===2CO2Ca(OH)2+CO2=====CaCO3↓+H2O
(7)ūóęŌ╩┬ĒŚ(xi©żng)Ż║ꬎ╚═©╚ļCOį┘╝ė¤ß�����Ż¼īŹ(sh©¬)“×(y©żn)═Ļ«ģ����Ż¼═Żų╣╝ė¤ß���Ż¼└^└m(x©┤)═©╚ļCOų┴įć╣▄└õģs���ĪŻ
(8)╬▓ÜŌ╠Ä└ĒŻ║ę“COėąČŠŻ¼▓╗─▄ļSęŌ┼┼Ę┼į┌┐šÜŌųą�Ż¼╠Ä└ĒĄ─įŁät╩ŪīóCO╚╝¤²Ą¶▐D(zhu©Żn)╗»×ķ¤o(w©▓)ČŠĄ─CO2╗“╩š╝»éõė├�ĪŻ
┐╝³c(di©Żn)13.╣żśI(y©©)¤ÆĶF
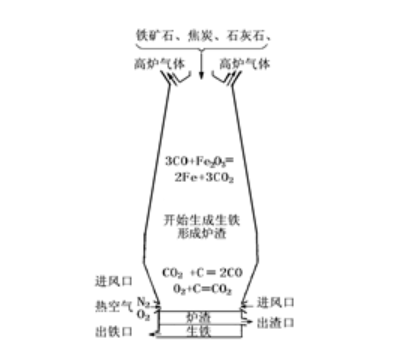
(1)įŁ└ĒŻ║į┌Ė▀£žŽ┬�����Ż¼└¹ė├Į╣╠┐┼cč§ÜŌĘ┤æ¬(y©®ng)╔·│╔Ą─▀ĆįŁä®(CO)īóĶFÅ─ĶFĄV╩»└’▀ĆįŁ│÷üĒ(l©ói)���ĪŻ
(2)įŁ┴ŽŻ║ĶFĄV╩»Ż║▀xō±ĄV╩»Śl╝■│ŻęŖ(ji©żn)Ą─ĶFĄV╩»ėą┤┼ĶFĄV(ų„ę¬│╔Ęų╩ŪFe3O4)Īó│ÓĶFĄV(ų„ę¬│╔Ęų╩ŪFe2O3)
Į╣╠┐ū„ė├Ż║1.╠ß╣®Ė▀£ž C+O2==Ė▀£ž==CO2 2.╠ß╣®CO CO2+C==Ė▀£ž==2CO
╩»╗ę╩»Ż║ū„ė├│²╚źSiO2CaCO3==Ė▀£ž===CaO+CO2↑ CaO+SiO2==Ė▀£ž===CaSiO3
(3)ų„ę¬įO(sh©©)éõŻ║Ė▀Āt
(4)ę▒¤Æ▀^(gu©░)│╠ųą░l(f©Ī)╔·Ą─╗»īW(xu©”)Ę┤æ¬(y©®ng)Ż║C+O2==³c(di©Żn)╚╝==CO2CO2+C==Ė▀£ž==2CO 3CO+Fe2O3==Ė▀£ž==2Fe+3CO2CaCO3==Ė▀£ž===CaO+CO2↑CaO+SiO2==Ė▀£ž===CaSiO3
ūóęŌŻ║╩»╗ę╩»Ą─ų„ę¬ū„ė├╩ŪīóĄV╩»ųąĄ─Č■č§╗»╣Ķ▐D(zhu©Żn)ūā?y©Łu)ķĀtį³���ĪŻ
¤ÆõōįO(sh©©)éõŻ║▐D(zhu©Żn)Āt���ĪóļŖĀtĪóŲĮĀt���ĪŻ
įŁ└ĒŻ║į┌Ė▀£žŚl╝■Ž┬��Ż¼ė├č§ÜŌ╗“ĶFĄ─č§╗»╬’░č╔·ĶFųą╦∙║¼Ą─▀^(gu©░)┴┐Ą─╠╝║═Ųõ╦³ļs┘|(zh©¼)▐D(zhu©Żn)ūā?y©Łu)ķÜŌ¾w║═Ātį³Č°│²╚ź�����ĪŻC+O2==³c(di©Żn)╚╝==CO2
┐╝³c(di©Żn)14.Įī┘Ą─õP╬g║═▒Żūo(h©┤)
(1)ĶF╔·õPĄ─Śl╝■╩ŪŻ║ĶF┼cO2����Īó╦«Įėė|(ĶFõPĄ─ų„ę¬│╔ĘųŻ║Fe2O3•XH2O)
(Ń~╔·Ń~ŠGĄ─Śl╝■Ż║Ń~┼cO2Īó╦«����ĪóCO2Įėė|ĪŻŃ~ŠGĄ─╗»īW(xu©”)╩ĮŻ║Cu2(OH)2CO3)
(2)ĶFĄ─õP╬gŚl╝■Ż║ėą╦«║═č§ÜŌ����Ż¼Ę└ų╣ĶFųŲŲĘ╔·õPĄ─┤ļ╩®Ż║ó┘▒Ż│ųĶFųŲŲĘ▒Ē├µĄ─ŪÕØŹĪóĖ╔į’
ó┌▒Ē├µ═┐▒Żūo(h©┤)─żŻ║╚ń═┐ė═�����Īó╦óŲß��ĪóļŖÕā�Īó┐Š╦{(l©ón)Ą╚
ó█ųŲ│╔║ŽĮŻ║▓╗õPõō
(3)ĶFõP║▄╩Ķ╦╔ČÓ┐ūŻ¼▓╗─▄ūĶĄK└’īėĄ─ĶF└^└m(x©┤)┼cč§ÜŌ��Īó╦«š¶ÜŌĘ┤æ¬(y©®ng)��Ż¼ę“┤╦ĶFųŲŲĘ┐╔ęį╚½▓┐▒╗õP╬g���ĪŻ
ĶFõP║▄╩Ķ╦╔ČÓ┐ūęū╬³╦«��Ż¼Ę┤Č°Ģ■(hu©¼)╝ė┐ņĶFĄ─╔·õP�Ż¼ę“Č°ĶF╔·õPæ¬(y©®ng)╝░Ģr(sh©¬)│²╚źĪŻ
(4)Č°õX┼cč§ÜŌĘ┤æ¬(y©®ng)╔·│╔ų┬├▄Ą─č§╗»õX▒Ī─ż�����Ż¼Å─Č°ūĶų╣õX▀M(j©¼n)ę╗▓Įč§╗»�Ż¼ę“┤╦Ż¼õXŠ▀ėą║▄║├Ą─┐╣Ė»╬gąį─▄���ĪŻ
┐╝³c(di©Żn)15.▒Żūo(h©┤)Įī┘┘Yį┤
▒Żūo(h©┤)Įī┘┘Yį┤Ą─ėąą¦═ŠÅĮŻ║(1)Ę└ų╣Įī┘Ą─Ė»╬g(2)ÅU┼fĮī┘Ą─╗ž╩š└¹ė├(3)ėąėŗ(j©¼)äØ║Ž└ĒĄ─ķ_(k©Īi)▓╔ĄV╬’(4)īżšęĮī┘Ą─┤·ė├ŲĘ
ęŌ┴xŻ║╣Ø(ji©”)╝sĮī┘┘Yį┤Ż¼£p╔┘Łh(hu©ón)Š│╬█╚Š
ŠÄ▌ŗ═Ų╦]Ż║
2024─Ļųą┐╝Ė„┐Ų─┐ųž³c(di©Żn)ų¬ūR(sh©¬)ģR┐é
ĪĪĪĪūŅą┬ųą┐╝┘YėŹ��Īóųą┐╝š■▓▀��Īó┐╝Ū░£╩(zh©│n)éõ�Īóųą┐╝ŅA(y©┤)£y(c©©)Īóõø╚ĪĘų?j©½n)?sh©┤)ŠĆĄ╚
ĪĪĪĪųą┐╝Ģr(sh©¬)ķgŠĆĄ─╚½▓┐ųžę¬╣Ø(ji©”)³c(di©Żn)
ĪĪĪĪ▒Mį┌"ųą┐╝ŠW(w©Żng)"╬óą┼╣½▒Ŗ╠¢(h©żo)

ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖC(j©®)�ĪóŲĮ░ÕĄ╚ęŲäė(d©░ng)įO(sh©©)éõįLå¢(w©©n)ųą┐╝ŠW(w©Żng)Ż¼2023ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąą���ŻĪ>>³c(di©Żn)ō¶▓ķ┐┤

















